Base della vita nel lago e dei fenomeni ossidativi (respirazione) di pesci, alghe e organismi tutti è l’ossigeno disciolto nell’acqua. La sua quantità (o la sua assenza) determina e gestisce le dinamiche di tutti gli organismi viventi: dai batteri (aerobici e anaerobici) ai molluschi, dalle uova e dagli avannotti al più grande dei pesci. Nessuno sfugge alla sua legge e, come ben sanno i pescatori per la scelta del posto dove calare le reti, risulta fondamentale conoscerne le importantissime variazioni durante il giorno e le bizzarrie metereologiche quotidiane e più in generale nel corso delle stagioni.
L’acqua, come del resto ogni liquido, può infatti contenere fra le proprie molecole un certo quantitativo di gas disciolti. Tutti abbiamo in mente cosa succede allo stappare di una bottiglia di acqua addizionata gas o di una bibita qualunque: la repentina diminuzione di pressione all’interno del contenitore modifica l’equilibrio e il gas (nel caso in esame anidride carbonica) istantaneamente inizia ad andarsene sotto forma di bollicine.
Nel lago avviene la stessa cosa e possiamo qui figurativamente immaginare che il tappo sia in qualche modo rappresentato dal peso dell’atmosfera sopra la superficie. Siamo abituati, dalle previsioni del tempo nei programmi televisivi e anche altrove, a veder interpretare le mappe meteo in base al movimento dei fronti delle perturbazioni e degli anticicloni. I più attenti avranno poi sicuramente osservato come siano le isobare (le curve di ugual pressione) a descrivere tali movimenti. Parlare di bel tempo ed alta pressione e all’opposto di condizioni metereologiche in peggioramento e bassa pressione risulta quindi molto semplice e comune. Poco evidenti sono invece le conseguenze sul lago e sull’ossigeno in esso disciolto. Nel seguire il nostro ragionamento bassa pressione equivale allora a stappare la bottiglia; alta pressione ad un ritorno in massa di ossigeno (e degli altri gas presenti in atmosfera) nelle acque anche in profondità.
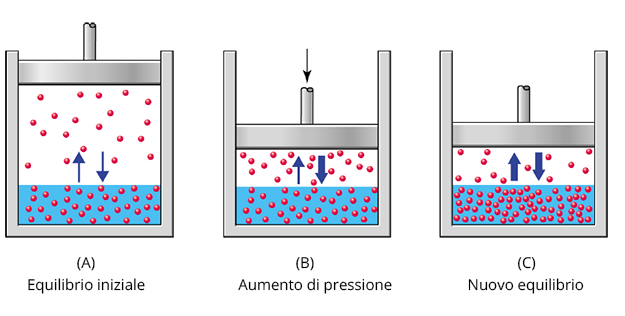
Esperimento che mette in evidenza la relazione fra quantità di gas disciolto e pressione esterna
L’effetto evidentissimo a chi passa le giornate sul lago di un improvviso temporale estivo, è quello di veder il lago riempirsi di bollicine di gas e alcune volte di percepire odori sgradevoli provenienti dal fondo (un po’ come quando si sentono i reflussi provenire da qualche tombino sulle strade). E al contrario, ma qui solo i pescatori con le reti se ne rendono conto, un ritorno al bello del tempo porta i pesci a scender più in profondità.
Al fenomeno, già di suo dinamicamente complesso e velocissimo (come del resto lo è lo stappare di una bottiglia), occorre però aggiungere un’altra legge della fisica dei gas disciolti: il loro rapporto con la temperatura.In qualche gita fuori porta molti si saranno accorti che con il caldo la pressione interna nella bottiglia della bibita è cresciuta e, al tatto, la bottiglia appare più dura. Questo avviene perché le molecole tutte, nella loro agitazione dovuta al caldo, trattengono meno il gas disciolto che a sua volta va ad occupare (aumentandone la pressione) la zona al di sopra del liquido fino all’instaurarsi di un nuovo equilibrio.
Ciò avviene anche nel nostro lago secondo le stesse dinamiche.In una giornata di bel tempo invernale ci sarà quindi un quantitativo di ossigeno disciolto nell’acqua molto maggiore che non nelle stesse condizioni di pressione in una calda giornata estiva.
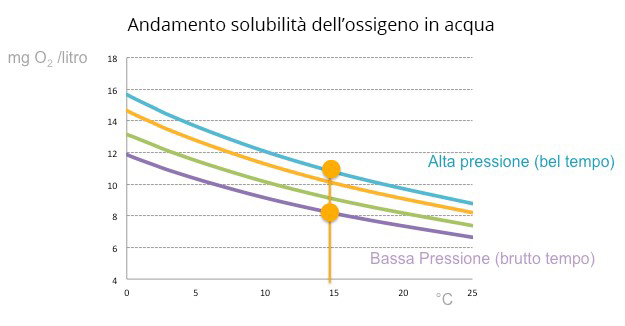
Il lago di Varese vanta una superficie di tutto rispetto di circa 15 chilometri quadrati ed una profondità media di 11 metri. Una massa di 160 milioni di metri cubi di acqua pronta istantaneamente a variare il proprio contenuto in ossigeno in base alla temperatura e alla pressione atmosferica secondo cicli giornalieri e stagionali. Non male come meccanismo di ossigenazione vero?E pensare che noi, poveri illusi, pensavamo di riuscire a ossigenarlo tutto (a quale scopo io me lo chiedo ancora ma questa è un’altra questione) con sparuti soffiatori di bollicine sparsi qua e là nel lago.
